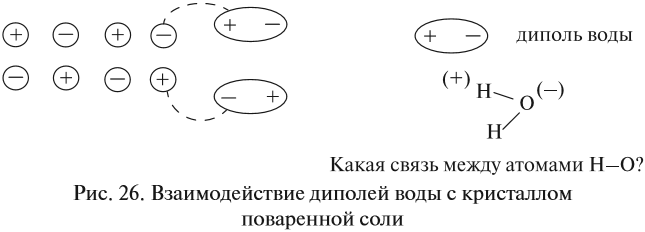
Кристаллический хлорид натрия, как правило, является нелетучим и нерастворимым в воде. Он состоит из ионов натрия (Na+) и ионов хлорида (Cl-), которые образуют кристаллическую решетку с жесткой структурой. Однако, когда хлорид натрия растворяется в воде, происходят химические реакции, которые меняют его свойства.
При растворении в воде, молекулы воды образуют водородные связи с ионами хлорида и натрия. Эта гидратация позволяет ионам свободно перемещаться в растворе и создает электропроводность. Ионы хлорида и натрия становятся подвижными и могут перемещаться под воздействием электрического поля.
Когда раствор хлорида натрия находится в присутствии электрического поля, положительно заряженные ионы натрия направляются к отрицательной электроде, а отрицательно заряженные ионы хлорида — к положительной электроде. Это движение ионов создает поток зарядов, что является основой для электрической проводимости раствора хлорида натрия.
Почему хлорид натрия не проводит ток?
Основным объяснением этого явления является структура кристаллической решетки NaCl. В кристаллической форме NaCl, натрий (Na+) и хлор (Cl-) ионны положены в строго определенных позициях. Эта симметричная структура не позволяет электронам свободно перемещаться, поэтому ток не может протекать через кристалл.
Однако, когда NaCl растворяется в воде, происходит процесс диссоциации, где ионы Na+ и Cl- разделяются. Эти свободные ионы могут перемещаться в растворе, создавая возможность для тока протекать. Кроме того, вода может атомарно или молекулярно ассоциироваться с ионами, образуя гидратированные ионы Na+ и Cl-. Эти гидратированные ионы также способны перемещаться в растворе и обучают раствору электропроводностью.
Таким образом, хлорид натрия сам по себе не проводит электрический ток в своей кристаллической форме из-за закрытой структуры, но его раствор обладает электропроводностью благодаря диссоциации и гидратации ионов в воде.
Кристаллическая структура
Кристаллический хлорид натрия (NaCl) обладает ионной структурой, состоящей из катионов натрия (Na+) и анионов хлорида (Cl-). В его кристаллической решетке каждый ион натрия окружен шестью ионами хлорида, а каждый ион хлорида окружен шестью ионами натрия.
В кристаллической структуре NaCl каждый ион занимает фиксированное положение и не может свободно перемещаться. Поэтому кристаллический хлорид натрия не обладает электрической проводимостью.
Однако, при растворении кристаллического хлорида натрия в воде происходит диссоциация ионов. В растворе ионы Na+ и Cl- свободно перемещаются, создавая возможность для передачи электрического тока. Именно поэтому раствор хлорида натрия обладает электропроводностью.
Распределение зарядов
Почему кристаллический хлорид натрия не проводит электрический ток, а его раствор обладает электропроводностью? Ответ на этот вопрос связан с распределением зарядов внутри кристаллической решетки и в растворе.
В кристаллической структуре натриевого хлорида ионы натрия (Na+) и ионы хлора (Cl-) расположены в решетке таким образом, что положительные ионы и отрицательные ионы равномерно распределены и замкнуты в кристаллической структуре. Именно благодаря этому равномерному распределению зарядов и отсутствию свободных зарядов в кристаллической решетке, хлорид натрия не проводит электрический ток.
В отличие от кристаллического хлорида натрия, его раствор состоит из свободных ионов Na+ и Cl-, которые могут перемещаться в растворе. Когда электролитический раствор подвергается воздействию электрического поля, на ионы начинают действовать электрические силы, вызывающие их движение к электродам. Это и объясняет электропроводность раствора хлорида натрия.
Таким образом, распределение зарядов в кристаллическом хлориде натрия и его растворе определяет возможность проводить электрический ток. В кристаллической структуре заряды равномерно распределены и замкнуты, поэтому ток не проходит. В растворе же, где имеются свободные ионы, возникает электропроводность.
Плотная упаковка
Кристаллический хлорид натрия (NaCl) обладает уникальной структурой, которая не позволяет ему проводить электрический ток в твердом состоянии. Это связано с особенностями плотной упаковки его ионов.
В кристаллической решетке хлорида натрия каждый ион натрия (Na+) окружен шестью ионами хлорида (Cl-), а каждый ион хлорида окружен шестью ионами натрия. Это образует трехмерную сетку, в которой положение ионообразных элементов жестко фиксировано.
Энергия, необходимая для изменения (смещения) положения ионов натрия и хлорида, в кристаллической решетке хлорида натрия очень высока. Это создает препятствие для перемещения ионов внутри кристалла и, как следствие, не позволяет электрическому току протекать через него в твердом состоянии.
Однако, в растворе хлорида натрия ионы натрия и хлорида могут свободно перемещаться, так как они отделены друг от друга под действием растворителя (обычно воды). В результате, в растворе появляются свободные заряженные частицы (ионы), которые способны проводить электрический ток. Это объясняет, почему раствор хлорида натрия обладает электропроводностью, в отличие от его твердого состояния.
Отсутствие свободных электронов
Кристаллический хлорид натрия (NaCl) представляет собой ионную сетку, состоящую из положительных и отрицательных ионов. В такой кристаллической решетке каждый ион обладает положительным или отрицательным зарядом.
В хлориде натрия все натриевые ионы (Na+) окружены шестью отрицательными ионами хлора (Cl-), а каждому отрицательному иону хлора соответствует шесть положительных ионов натрия. Такое распределение зарядов обеспечивает стабильность кристаллической решетки.
Однако, в кристаллической сетке кристаллического хлорида натрия отсутствуют свободные электроны, которые могли бы двигаться внутри решетки и осуществлять электропроводность. Кристаллический хлорид натрия не является проводником электричества, поскольку все его электроны остаются привязанными к своим ионам и не могут перемещаться.
Однако, когда хлорид натрия растворяется в воде, происходит процесс диссоциации, в результате которого образуются ионы натрия и хлора. Эти ионы становятся подвижными и могут перемещаться в растворе. Благодаря наличию свободных ионов, раствор хлорида натрия обладает электропроводностью. Прохождение электрического тока через раствор происходит за счет движения заряженных ионов в направлении электрического поля, создаваемого внешним источником напряжения.
Растворимость и электропроводность
Однако, когда кристаллический хлорид натрия растворяется в воде, происходит процесс диссоциации, при котором кристаллическая решетка разрушается и образуются свободные ионы натрия (Na+) и хлорида (Cl-). Эти ионы способны свободно перемещаться в растворе, и поэтому раствор хлорида натрия обладает электропроводностью.
Растворимость вещества зависит от нескольких факторов, включая температуру и концентрацию раствора. При повышении температуры растворимость хлорида натрия увеличивается, так как теплота реакции диссоциации увеличивается. Также, при увеличении концентрации раствора, растворимость может увеличиваться или уменьшаться в зависимости от взаимодействия ионов в растворе.
- Изменение растворимости может иметь важное значение в химических реакциях и процессах, таких как осаждение и выделение веществ из растворов.
- Электропроводность раствора хлорида натрия зависит от его концентрации и температуры. Чем выше концентрация раствора и температура, тем выше электропроводность.
- Растворы хлорида натрия, а также других электролитов, используются в различных отраслях промышленности, медицине и науке для проведения электролиза, электрохимических процессов и получения различных продуктов.
Таким образом, растворимость и электропроводность хлорида натрия связаны с его диссоциацией в растворе, которая позволяет ионам свободно перемещаться и создавать электрический ток.
Ионизация в воде
Кристаллический хлорид натрия (NaCl) не проводит электрический ток в твердом состоянии, поскольку его ионы не могут свободно двигаться и переносить электрический заряд. Однако, когда хлорид натрия растворяется в воде, происходит процесс ионизации.
Ионизация в воде означает, что молекулы воды взаимодействуют с кристаллическими ионами хлорида натрия, разделяя их на положительно заряженные натриевые (Na+) и отрицательно заряженные хлоридные (Cl-) ионы.
| Ион | Заряд |
|---|---|
| Натриевый ион (Na+) | + |
| Хлоридный ион (Cl-) | — |
Эти ионы, за счет своей заряженности, могут свободно двигаться в растворе воды, перемещаясь под действием электрического поля. Это позволяет раствору хлорида натрия проявлять электропроводность.
Ионизация в воде относится к образованию электролитического раствора, где ионы в воде проводят электрический ток. Это объясняет различие в электропроводности между твердым кристаллическим хлоридом натрия и его раствором.
Вопрос-ответ:
Почему кристаллический хлорид натрия не проводит электрический ток?
Кристаллический хлорид натрия не проводит электрический ток, потому что в его кристаллической структуре все ионы находятся в кристаллической решетке и не могут свободно двигаться. Для проведения электрического тока требуется наличие подвижных частиц, таких как ионы или электроны.
Почему раствор хлорида натрия обладает электропроводностью?
Раствор хлорида натрия обладает электропроводностью, потому что при растворении в воде кристаллическая структура растворяется и образуются свободные ионы Na+ и Cl-, которые способны свободно двигаться под воздействием электрического поля и переносить электрический заряд через раствор.
Почему ионы Na+ и Cl- свободно двигаются в растворе хлорида натрия?
Ионы Na+ и Cl- свободно двигаются в растворе хлорида натрия, потому что вода разрушает кристаллическую решетку ионного соединения, образуя сольватационные оболочки вокруг ионов. Эти оболочки уменьшают притяжение между ионами и позволяют им свободно двигаться.
Как происходит проведение электрического тока в растворе хлорида натрия?
В растворе хлорида натрия проведение электрического тока происходит посредством движения ионов Na+ и Cl-. Под воздействием электрического поля ионы перемещаются к электродам с противоположными зарядами — положительно заряженные ионы (Na+) к отрицательному электроду, а отрицательно заряженные ионы (Cl-) к положительному электроду. Таким образом, электрический ток протекает через раствор.
Почему раствор хлорида натрия проводит электрический ток, а кристаллическая соль — нет?
Раствор хлорида натрия проводит электрический ток, так как в процессе растворения соль диссоциирует на ионы Na+ и Cl-, которые могут свободно двигаться в растворе и переносить электрический заряд. В то же время, кристаллическая соль не проводит электрический ток, так как ионы в ней находятся в неподвижном состоянии и не могут передвигаться для транспортировки заряда.
Почему кристаллический хлорид натрия не проводит электрический ток?
Кристаллическая структура хлорида натрия обладает жесткой решеткой, в которой положительно заряженные ионы натрия и отрицательно заряженные ионы хлора занимают фиксированные позиции. Поэтому, в кристаллическом состоянии, электроны не могут перемещаться и не проводят электрический ток.
Почему раствор хлорида натрия обладает электропроводностью?
Когда хлорид натрия растворяется в воде, он диссоциирует на ионы натрия (Na+) и ионы хлора (Cl-). Эти ионы свободно перемещаются в растворе, что позволяет электронам переноситься от одного иона к другому, образуя электрический ток. Таким образом, раствор хлорида натрия обладает электропроводностью.